لیگاند ایزونیکوتینو هیدرازید
ایزونیکوتینو هیدرازید [۱] که به عنوان آیزونیازید [۲] نیز شناخته می شود ، یک ترکیب آلی است که جزو اولین داروهایی می باشد که برای جلوگیری و درمان بیماری سل [۳] (بیماری سل هنوز هم یکی از مرگبارترین بیماری ها می باشد که سالانه باعث مرگ ۳ میلیون نفر در سرتاسر جهان می شود ) مورد استفاده قرار گرفت. این ترکیب برای اولین بار در سال ۱۹۱۲ سنتز گردید ولی خاصیت ضد سلی این ماده در اوایل دهه ۱۹۵۰ گزارش شد. این ماده در بافت های زنده خاصیت بازدارندگی بالایی در مقابل نوع خاصی از باکتری های سل (Mycobacterium tuberculosis H37Rv) دارا می باشد. مدتی بعد ثابت شد که این ماده دارای خواص ضد افسردگی [۴] نیز می باشد. در واقع این ماده یکی از اولین داروهای ضد افسردگی است و علاوه بر آن در درمان بسیاری از بیماری های باکتریایی مورد استفاده قرار می گیرد [۱-۵].

هیدرازون ها (Hydrazone ) که محصولی از واکنش تراکمی ایزونیکوتینوهیدرازید با پیریدین- آلدهید و کتون ها می باشند نسبت به خود ایزونیکوتینوهیدرازید خواص ضد سلی بهتری نشان می دهند[۶]. این مدعا توسط تشکیل کمپلکس های پایدار با عناصر بلوک d و f به اثبات رسید. هیدرازون ها دارای خواص ضد باکتری ، ضد تومور ، ضد تشنج [۵] و مسکن [۶] می باشند[۷-۱۰].
مطاله بر روی هیدرازون ها به دلیل فعالیت فیزیولوژیکی ، قابلیت کوئوردینه شوندگی بالا و کاربرد در شیمی تجزیه ، افزایش چشمگیری داشته است[۱۱-۱۳]. شیف باز های هیدرازونی آرویل یا هتروآرویل [۷]در مقایسه با شیف باز های هیدرازونی ساده ، دارای محل های دهنده بیشتری می باشند که خود باعث ایجاد گستره ای از ویژگی ها و خواص در این مواد می باشد. مطالعه بر روی لیگاند هایی مانند هیدرازون ها به دلیل توانایی تغییر نوع کئوردیناسیون ، تمایل به ایجاد محصولات دارای شیمی فضایی [۸]و دستیابی به اعداد کئوردیناسیون بالا ، توانایی کئوردینه شدن به صورت لیگاند خنثی یا لیگاند دپروتونه و همچنین انعطاف پذیری جهت کئوردیناسیون های مختلف ، افزایش چشمگیری یافته است. چندین کمپلکس فلزی از شیف بازها با لیگاند های دهنده اکسیژن و نیتروژن و همچنین دهنده اکسیژن و گوگرد ، سنتز گردیده و مورد بررسی قرارگرفتند [۱۴-۱۸]. لازم به ذکر است که هیدرازون های مشتق شده از ایزونیکوتینیک اسید هیدرازید برای اولین بار در سال ۱۹۵۴ سنتز شد. Sah و همکارانش [۱۹] ، با استفاده از ایزئنیکوتینو هیدرازید و آلدهید ها و کتون های مختلف ، هیدرازون های مختلفی را سنتز نمودند (هیدرازون های بدست آمده از ایزونیکوتینو هیدرازید معروف به hydrazide-hydrazones می باشند.). ساختار هیدرازون ها در شکل ۱‑۱ ، نشان داده شده است. این ترکیبات دارای قدرت ضد سلی بالاتر نسبت به ایزونیکوتینو هیدرازید بوده و ثابت گردید دارای سمیت پایین تری نسبت به آن می باشند. [۱۹, ۲۰]
کمپلکس های سنتزی با لیگاند ایزونیکوتینو هیدرازید
Lucia Viorica Ababei ، در رساله دکترای خود در سال ۲۰۱۲ ، موفق به سنتز و شناسایی کمپلکس فلزات مس و کبالت و نیکل و روی گردید [۲۱]. ترکیبات سنتزی وی در جدول ۱‑۱ ، آورده شده است : جدول ۱‑۱ : لیست ترکیبات سنتزی Ababei با استفاده از ایزونیکوتینوهیدرازید


بررسی تئوری لیگاند ایزونیکوتینو هیدرازید
هندسه بهینه ایزونیکوتینو هیدرازید
در شکل ۱‑۳ ، نمایی از هندسه بهینه شده برای لیگاند خنثی ایزونیکوتینو هیدرازید را مشاهده می کنید که با روش DFT ، و مجموعه پایه ub3lyp/6-311++g(d,p) ، بدست آمده است. انرزی ساختار بهینه شده پس از تصحیح برابر است با :

در شکل ۱‑۴ ، پویش زاویه دو وجهی O=C-N-H در لیگاند ایزونیکوتینو هیدرازید را مشاهده می نمایید که با روش DFT ، و مجموعه پایه بدست آمده است. پویش زوایه دو وجهی مذکور نشان می دهد که وقتی زاویه دو وجهی به ۱۸۰ درجه می رسد مولکول پایدارترین شکل خود را داراست که در این حالت از طرف نیتروژن (۱۵) و اکسیژن (۱۴) خود می تواند به فلز کئوردینه شود. البته زاویه دو وجهی صفر درجه نیز پایدار می باشد. مولکول در حالت جامد بیشتر به فرم دو وجهی صفر درجه می باشد (داده های کریستالوگرافی زاویه دو وجهی صفر درجه را نشان می دهد ) زیرا در این حالت پیوند هیدروژنی درون مولکولی بین نیتروژن آمین (۱۵) و هیدروژن (۸) حلقه تشکیل شده و منجر به ایجاد یک حلقه شش ضلعی پایدار می شود. به نظر می رسد این امر (پیوند هیدروژنی) مدت زمان حضور مولکول در زاویه دو وجهی صفر درجه را افزایش می دهد که در طیف NMR نیز می تواند خود را نشان بدهد. در قسمت بررسی طیف NMR ، به این موضوع خواهیم پرداخت.

شکل و انرژی اوربیتال مولکولی ایزونیکوتینوهیدرازید
در شکل ۱‑۵ ، نمایش توزیع بار تئوری برای لیگاند ایزونیکوتینو هیدرازید به روش Full NBOرا مشاهده می نمایید. نتایج محاسبات نشان می دهد که بیشترین بار منفی بر روی نیتروژن (۱۵) به مقدار عددی ۶۳۹/۰ – ، اکسیژن (۱۴) به مقدار عددی ۶۰۷/۰ – و نیتروژن (۶) به مقدار عددی ۴۴۱/۰ – ، توزیع شده است که به آنها خصلت هسته دوستی بالایی می دهد. در هنگامی که ایزونیکوتینو هیدرازید به عنوان لیگاند عمل می کند بیشتر از سمت نیتروژن (۱۵) و اکسیژن (۱۴) به فلز متصل می شود و می تواند به عنوان یک لیگاند دو دندانه عمل کند در برخی موارد این لیگاند از طرف نیتروژن (۶) به عنوان یک لیگاند تک دندانه به فلز متصل می شود.

شکل ۱‑۵ : نمایش توزیع بار تئوری برای لیگاند ایزونیکوتینو هیدرازید به روش Full NBO
در شکل ۱‑۶ ، نمایش اوربیتال مولکولی HOMO و LUMO لیگاند ایزونیکوتینو هیدرازید مشاهده می نمایید که اختلاف انرژی تراز های HOMO و LUMO نیز در آنها محاسبه شده است که برابر با ۲۱۳۵/۸ الکترون ولت می باشد.
در جدول ۱‑۳ ، نمایش پیکربندی الکترون های ظرفیتی برای لیگاند ایزونیکوتینو هیدرازید با روش NBO را مشاهده می نمایید.

شکل ۱‑۶ : نمایش اوربیتال مولکولی HOMO و LUMO لیگاند ایزونیکوتینو هیدرازید و محاسبه اختلاف انرژی تراز های HOMO و LUMO
جدول ۱‑۳ : نمایش پیکربندی الکترون های ظرفیتی برای لیگاند ایزونیکوتینو هیدرازید با روش NBO

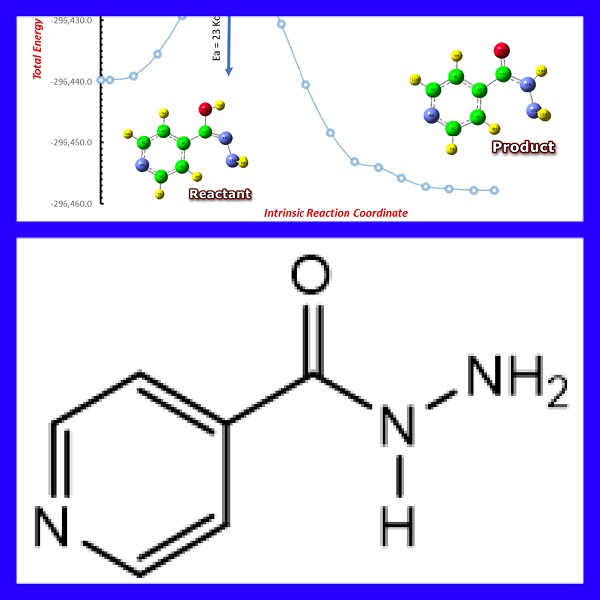
بررسی مسیر واکنش تبدیل فرم انول به کتون در لیگاند ایزونیکوتینو هیدرازید
در شکل ۱‑۷ ، نحوه تبدیل فرم انول به کتون در ایزونیکوتینو هیدراید به همراه انرژی فعال سازی را مشاهده می نمایید. برای بدست آوردن مسیر واکنش تبدیل فرم انول ایزونیکوتینو هیدرازید به فرم کتون ، از روش DFT ، و مجموعه پایه ub3lyp/6-311++g(d,p) استفاده شده است. طبق اطلاعات بدست آمده از محاسبات (جدول ۱‑۴) فرم کتون ایزونیکوتینو هیدرازید پایدارتر از فرم انول (به اندازه ۱۷ کیلوکالری بر مول) می باشد.


بررسی طیف های مختلف لیگاند ایزونیکوتینو هیدرازید
بررسی طیف NMR ایزونیکوتینو هیدرازید
طیف ۱HNMR تجربی لیگاند ایزونیکوتینو هیدرازید را در شکل ۱‑۸ ، مشاهده می نمایید[۳۰]. طیف های تئوری محاسبه شده با روش DFT ، و مجموعه پایه ub3lyp/6-311++g(d,p) را در شکل ۱‑۹ (نمایش جابه جایی شیمیایی تئوری (۱HNMR ) برای ایزونیکوتینو هیدرازید برای هندسه بهینه فرم انول) ، شکل ۱‑۱۰ (نمایش جابه جایی شیمیایی تئوری (۱HNMR ) برای ایزونیکوتینو هیدرازید با زاویه دو وجهی ۱۸۰ درجه) ، شکل ۱‑۱۱ (نمایش جابه جایی شیمیایی تئوری (۱HNMR ) برای ایزونیکوتینو هیدرازید برای هندسه بهینه فرم کتون) و شکل ۱‑۱۲ (نمایش جابه جایی شیمیایی تئوری (۱HNMR ) برای ایزونیکوتینو هیدرازید برای حالت گذار تبدیل انول به کتون) مشاهده می نمایید. مقایسه طیف تئوری برای ایزونیکوتینو هیدرازید فرم انول با زاویه دو وجهی صفر (هندسه با روشی که طیف NMR گرفته شده بهینه شده است) نسبت به طیف تجربی در هیدروژن های (۱۳) ، (۱۶) و (۱۷) اختلاف زیادی دارد که نشان دهنده این موضوع می باشد که دو مولکول تجربی و تئوری یکسان نیستند و در نتیجه این موضوع را که مولکول ایزونیکوتینو هیدرازید در حالت محلول به فرم کتون می باشد را تایید می کند (در حالت جامد انول یا کتون بودن به راحتی با طیف FT-IR مشخص می شود زیرا حالت کتون پیک ارتعاش کششی C=O را نشان می دهد ولی حالت انول پیک مربوط به ارتعاشات کششی O-H و C-O را نشان می دهد). مقایسه طیف تجربی با طیف تئوری فرم کتون با زاویه دو وجهی ۱۸۰ درجه ( با هندسه بهینه شده) نیز اختلاف بالایی را در هیدروژن (۱۳) نشان می دهد که نشان دهنده این موضوع می باشد که مولکول نمی تواند در حالتی که طیف تجربی گرفته می شود (حالت محلول در DMSO ) در زاویه دو وجهی ۱۸۰ درجه بوده باشد. در بین طیف ها، طیف مربوط به فرم کتون با زاویه دو وجهی صفر درجه بیشترین نزدیکی را به داده های تجربی دارد البته این طیف نیز درهیدروژن (۱۳) اختلاف قابل توجهی با طیف تجربی دارد. با توجه به طیف حالت گذار و مقایسه آن با طیف تجربی ، به نظر می رسد مولکول ایزونیکوتینو هیدرازید در حالت محلول به شکل حدواسط بین فرم انول و کتون (بیشتر متمایل به فرم کتون می باشد یعنی هیدروژن (۱۳) به نیتروژن (۱۲) نزدیکتر است) خود می باشد. جهت بررسی های بیشتر طیف های NMR مربوط به مسیر واکنش به ضمایم رجوع شود. در شکل ۱‑۱۳ ، طیف ۱۳CNMR تجربی [۳۰]برای ایزونیکوتینو هیدرازید را مشاهده می نمایید. طیف های ۱۳CNMR تئوری را برای حالتهای مختلف ایزونیکوتینو هیدرازید در شکل ۱‑۱۴ ، شکل ۱‑۱۵ ، شکل ۱‑۱۶ و شکل ۱‑۱۷ مشاهده می نمایید که فرم کتون با زاویه دو وجهی صفر درجه بیشترین نزدیکی را با داده های تجربی دارا می باشد. داده های ۱۳CNMR برای حالت گذار نیز نشان می دهد که به احتمال زیاد مولکول به صورت حدواسطی از حالت انول و کتون می باشد.





شکل ۱‑۱۲ : نمایش جابه جایی شیمیایی تئوری (۱HNMR ) برای ایزونیکوتینو هیدرازید برای حالت گذار تبدیل انول به کتون

شکل ۱‑۱۳ : نمایش طیف ۱۳CNMR تجربی برای ایزونیکوتینو هیدرازید

شکل ۱‑۱۴ : نمایش جابه جایی شیمیایی تئوری (۱۳CNMR ) برای ایزونیکوتینو هیدرازید برای هندسه بهینه فرم انول

شکل ۱‑۱۵ : نمایش جابه جایی شیمیایی تئوری (۱۳CNMR ) برای ایزونیکوتینو هیدرازید برای حالت گذار تبدیل انول به کتون

شکل ۱‑۱۶ : نمایش جابه جایی شیمیایی تئوری (۱۳CNMR ) برای ایزونیکوتینو هیدرازید برای هندسه بهینه فرم کتون

شکل ۱‑۱۷ : نمایش جابه جایی شیمیایی تئوری (۱۳CNMR ) برای ایزونیکوتینو هیدرازید با زاویه دو وجهی ۱۸۰ درجه
بررسی طیف IR ، رامان و VCD ایزونیکوتینو هیدرازید
در شکل ۱‑۱۸ ، مقایسه طیف تجربی [۳۰] و طیف تئوری محاسبه شده با روش DFT ، و مجموعه پایه ub3lyp/6-311++g(d,p) را مشاهده می نمایید که تطابق خوبی با یکدیگر دارند. پیک ۳۳۰۴ در طیف تجربی مربوط یه ارتعاش نا متقارن ، ۳۱۰۵ مربوط به ارتعاش متقارن ، ۱۶۶۲ 〖cm〗^(-۱) مربوط یه کششی (داده های قبلی را در مورد فرم کتون تایید می کند)، ۱۴۶۶-۱۴۱۱ 〖cm〗^(-۱) مربوط به کششی حلقه و ۱۱۴۱-۶۷۰ 〖cm〗^(-۱) مربوط به خمشی خارج صفحه ای می باشد.

شکل ۱‑۱۸ : مقایسه طیف IR تئوری و تجربی برای لیگاند ایزونیکوتینوهیدرازید
در شکل ۱‑۱۹ ، طیف رامان تئوری لیگاند ایزونیکوتیو هیدرازید را مشاهده می نمایید که با روش DFT ، و مجموعه پایه محاسبه شده است.
در شکل ۱‑۲۰ ، طیف VCD تئوری لیگاند ایزونیکوتیو هیدرازید را مشاهده می نمایید که با روش DFT ، و مجموعه پایه محاسبه شده است.

شکل ۱‑۱۹ : نمایش طیف رامان تئوری لیگاند ایزونیکوتیو هیدرازید

شکل ۱‑۲۰ : نمایش طیف VCD تئوری لیگاند ایزونیکوتیو هیدرازید
بررسی واکنش پذیری لیگاند ایزونیکوتینوهیدرازید
در جدول ۱‑۵ ، داده های مرتبط با واکنش پذیری لیگاند ایزونیکوتینو هیدرازید را مشاهده می نمایید. نتایج حاصل از محاسبات نشان می دهد ایزونیکویتینو هیدرازید پس از حل شدن در اّب از لحاظ انرژی اوربیتال مولکولی تغییر چندانی نمی کند. میزان انرژی یونیزاسیون در حالت محلول در آب کاهش می یابد این در حالی است که سطح انرژی اوربیتال های HOMO و LUMO و اختلاف انرژی آنها تفاوت چندانی بین حالت محلول در آب و حالت گازی ندارد.
جدول ۱‑۵ : نمایش داده های مرتبط با واکنش پذیری لیگاند ایزونیکوتینو هیدرازید

بررسی قطبیت و خواص نوری غیر خطی لیگاند ایزونیکوتینو هیدرازید
در جدول ۱‑۶ ، داده های مرتبط با قطبیت و قطبش پذیری برای لیگاند ایزونیکوتینوهیدرازید را مشاهده می نمایید.
در جدول ۱‑۷ ، نمایش داده های فراقطبش پذیری برای لیگاند ایزونیکوتینو هیدرازید را مشاهده می نمایید.
جدول ۱‑۶ : نمایش داده های مرتبط با قطبیت و قطبش پذیری برای لیگاند ایزونیکوتینوهیدرازید

جدول ۱‑۷ : نمایش داده های فراقطبش پذیری برای لیگاند ایزونیکوتینو هیدرازید

اطلاعات تکمیلی درباره قطبیت مراتب بالاتر در قسمت ضمایم ، پیوست شده است.
بررسی خواص ترمودینامیکی لیگاند ایزونیکوتینوهیدرازید
در جدول ۱‑۸ ، داده های ترمودینامیکی لیگاند ایزونیکوتینو هیدرازید را مشاهده می نمایید.
در جدول ۱‑۹، نمایش انرژی گرمایی ، آنتروپی و ظرفیت گرمایی برای لیگاند ایزونیکوتینو هیدرازید را مشاهده می نمایید.
جدول ۱‑۸: نمایش داده های ترمودینامیکی برای لیگاند ایزونیکوتینو هیدرازید

جدول ۱‑۹ : نمایش انرژی گرمایی ، آنتروپی و ظرفیت گرمایی برای لیگاند ایزونیکوتینو هیدرازید

منابع :
[۱] S. Ianelli, P. Mazza, M. Orcesi, C. Pelizzi, G. Pelizzi, and F. Zaini, “Synthesis, structure, and biological activity of organotion compounds with Di-2-pyridylketone and phenyl (2-pyridyl) ketone 2-aminobenzoylhydrazones,” Journal of Inorganic Biochemistry, vol. 60, no. 2, pp. 89-108, 1995.
[۲] P. Mazza, M. Orcesi, C. Pelizzi, G. Pelizzi, G. Predieri, and F. Zaini, “Synthesis, structure, antimicrobial, and genotoxic activities of organotin compounds with 2, 6-diacetylpyridine nicotinoyl-and isonicotinoylhydrazones,” Journal of Inorganic Biochemistry vol. 48, no. 4, pp. 251-270, 1992.
[۳] H. H. Fox, “The chemical approach to the control of tuberculosis,” Science, vol. 116, no. 3006, pp. 129-134, 1952.
[۴] Z. Cesur, S. Büyüktimkin, N. Büyüktimkin, and S. Derbentli, “Synthesis and Antimicrobial Evaluation of Some Arylhydrazones of 4‐[(۲‐Methylimidazo [1, 2‐a] pyridine‐۳‐yl) azo] benzoic Acid Hydrazide,” Archiv der Pharmazie vol. 323, no. 3, pp. 141-144, 1990.
[۵] B. Bottari, R. Maccari, F. Monforte, R. Ottana, E. Rotondo, and M. Vigorita, “Isoniazid-related copper (II) and nickel (II) complexes with antimycobacterial in vitro activity. Part 9,” Bioorganic and Medicinal Chemistry Letters, vol. 10, no. 7, pp. 657-660, 2000.
[۶] S. Kakimoto and K. Yashamoto, “Studies on antitubercular compounds. X. Condensation products of aldehydes and acid hydrazides of pyridine group,” Pharmaceutical bulletin, vol. 4 no. 1, pp. 4-6, 1956.
[۷] J. Pandey, R. Pal, A. Dwivedi, and K. Hajela, “Synthesis of some new diaryl and triaryl hydrazone derivatives as possible estrogen receptor modulators,” Arzneimittelforschung, vol. 52, no. 1, pp. 39-44, 2002.
[۸] Z.-Y. Yang, R.-D. Yang, F.-S. Li, and K.-B. Yu, “Crystal structure and antitumor activity of some rare earth metal complexes with Schiff base,” Polyhedron, vol. 19, no. 26, pp. 2599-2604, 2000.
[۹] V. P. Singh, S. Singh, and A. Katiyar, “Synthesis, physico-chemical studies of manganese (II), cobalt (II), nickel (II), copper (II) and zinc (II) complexes with some p-substituted acetophenone benzoylhydrazones and their antimicrobial activity,” Journal of Enzyme Inhibition and Medicinal Chemistry, vol. 24, no. 2, pp. 577-588, 2009.
[۱۰] H. D. Revanasiddapp and B. P. Dayananda, “A new reagent system for the spectrophotometric determination of selenium in environmental and cosmetic samples,” Central European Journal of Chemistry, vol. 4, no. 4, pp. 592-603, 2006
[۱۱] D. Rastogi, S. Sahni, V. Rana, and S. Dua, “Five and six coordinate complexes of trivalent Manganese and Cobalt with Benzoyl Hydrazones,” Coord. Chem vol. 8, no. 2, pp. 97-104, 1978.
[۱۲] R. M. El-Bahnasawy, S. E. El-Meleigy, and A. El-Tawansi, “o-hydroxyaroyl-isonicotinoyl hydrazones as chelating agents with divalent transition metal ions,” Trans. Met. Chem, vol. 19, no. 3, pp. 270-274, 1994.
[۱۳] K. K. Narang and V. P. Singh, “Synthesis, Electronic and ESR Spectral Studies on Five-Coordinate Copper (II) Chloride Complexes with Monoacyl-Hydrazines and Hydrazones,” Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry, vol. 27, no. 5, pp. 721-736, 1997.
[۱۴] M. J. Clear, “Transition metal complexes in cancer chemotherapy,” Coord. Chem. Rev, vol. 12, no. 4, p. 405, 1974.
[۱۵] M. Das and S. Livingstone, “Metal chelates of dithiocarbazic acid and its derivatives. IX. Metal chelates of ten new Schiff bases derived from S-methyldithiocarbazate,” Inorganica Chimica Acta, vol. 19, pp. 5-10, 1976.
[۱۶] M. A. Ali and R. Bose, “Transition metal complexes of furfural and benzil schiff bases derived from S-benzyldithiocarbazate,” Polyhedron, vol. 3, no. 5, pp. 517-522, 1984.
[۱۷] M. A. Ali and R. N. Bose, “Metal complexes of schiff bases formed by condensation of 2-methoxybenzaldehyde and 2-hydroxybenzaldehyde with S-benzyldithiocarbazate,” J. Inorg. Nucl. Chem, vol. 39, no. 2, pp. 265-269, 1977.
[۱۸] M. Akbar Ali and S. Livingstone, “Metal complexes of sulphur-nitrogen chelating agents,” Coordination Chemistry Reviews, vol. 13, no. 2, pp. 101-132, 1974.
[۱۹] P. P. T. Sah and S. A. Peoples, “Isonicotinyl hydrazones as antitubercular agents and derivatives for identification of aldehydes and ketones,” J. Am. Pharm. Assoc vol. 43, no. 9, pp. 513-524, 1954.
[۲۰] J. Cuthbert and L. Bruce, “The combined use of isoniazid and nupasal-213 in pulmonary tuberculosis: A study of the toxic effects and the development of cross-resistance between isoniazid and nupasal-213 in the treatment of pulmonary tuberculosis,” British Journal of Tuberculosis and Diseases of the Chest, vol. 51, no. 3, pp. 265-270, 1957.
[۲۱] V. ABABEILUCICA, “Transition metal complexes with hydrazones derived from isonicotinic acid hydrazide,” Phd, Faculty of Chemistry, Univercity of Bucharest 2012.
[۲۲] P. V. Bernhard, G. J. Wilson, P. C. Sharpe, D. S. Kalinowski, and D. R. Richardson, “Iron chelators of the dipyridylketone thiosemicarbazone class: precomplexation and transmetalation effects on anticancer activity,” Journal of medicinal chemistry, vol. 52, no. 2, pp. 407-415, 2008.
[۲۳] B. Mirtamizdoust, “Synthesis and structural investigation of novel lead(II) coordination compounds using some O, N and S donor ligands and examination of the possibility of preparing nano-compounds from them,” Phd, inorganic chemistry, tabriz, 2012.
[۲۴] C. Wong, J. Kwok, and D. Richardson, “PCTH : a novel orally active chelator of the aroylhydrazone class that induces iron excretion from mice,” Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, vol. 1739, no. 1, pp. 70-80, 2004.
[۲۵] B. Shaabani et al., “Crystal structure and topological ferrimagnetic behavior of a new 2D metal–organic hybrid manganese complex [Mn۳(N۳)۴(L)۲(H۲O)۲]n·۰٫۶(C۲H۵OH)·۱٫۴(H۲O) with the AF/AF/F alternating sequence (HL = N′-((pyridine-2-yl)methylene) isonicotinohydrazide)isonicotinohydrazide),” Polyhedron, vol. 49, no. 1, pp. 61-66, 2013.
[۲۶] R. Fekri and B. Shaabani, “Synthesis and Characterization of Ni (II) Complex with Tridentate Ligand of Schiff’s Bases of Salicylaldehyde with Thiocyanate Ligand,” J. Appl. Environ. Biol. Sci, vol. 3, no. 8, pp. 75-80, 2013.
[۲۷] G. H. Shahverdizadeh, E. R. Tiekink, and B. Mirtamizdoust, “catena-Poly [[lead (II)–N’-[1-(pyridin-2-yl-N) ethylidene] isonicotinohydrazidato-3N’, O: N1] perchlorate],” Acta Crystallographica Section E: Structure Reports Online, vol. 67, no. 12, pp. m1727-m1728, 2011.
[۲۸] S. S. Kazemi, “Synthesis and Study of Some Transition Metals Complexes with Acyl hydrazone Schiff Base and Azi
e Ligand,” Msc, Faculty of Chemistry, University of Tabriz, Department of Inorganic Chemistry, 2011.
[۲۹] M. E. Casida, C. Jamorski, K. C. Casida, and D. R. Salahub, “Molecular excitation energies to high-lying bound states from time-dependent density-functional response theory: Characterization and correction of the time-dependent local density approximation ionization threshold,” The Journal of chemical physics, vol. 108, pp. 4439-4449, 1998.
[۳۰] Available: http://www.aist.go.jp/
- ↑isonicotinohydrazide
- Isoniazid (Laniazid, Nydrazid) ↑
- Tuberculosis ↑
- Antidepressive ↑
- Anticonvulsant ↑
- Analgesic ↑
- Aroyl or heteroaroyl ↑
- Stereochemistry ↑
- ۲-pyridinecarbaldehydeisonicotinoyl hydrazine ↑