سرب در جدول تناوبی در انتهای گروه چهاردهم قرار گرفته است و دارای ظرفیتهای ۲+ و ۴+ می باشد. پایداری ترکیبهای با عدد اکسایش ۴+ عناصر این گروه از کربن به سمت سرب کم می گردد و برعکس پایداری ترکیبهای با عدد اکسایش ۲+ این عناصر از کربن به سمت سرب افزایش می یابد. از این رو سیلیسیم مونوکسید SiO، ناپایدار و سیلیسیم دی اکسید SiO۲، بسیار پایدار است. اما در مورد سرب PbO پایدارتر از PbO۲ است.
سرب به علت وزن مخصوص و جرم اتمی بالا، در کاربردهای هستهای به منظور حفاظت در مقابل اشعه گاما مورد استفاده قرار می گیرد. سرب در مقابل سولفوریک اسید مقاوم است که ناشی از پوشش غیرمحلول سرب سولفات می باشد از این رو از سرب به طور وسیعی در نقل و انتقال سولفوریک اسید استفاده می شود .
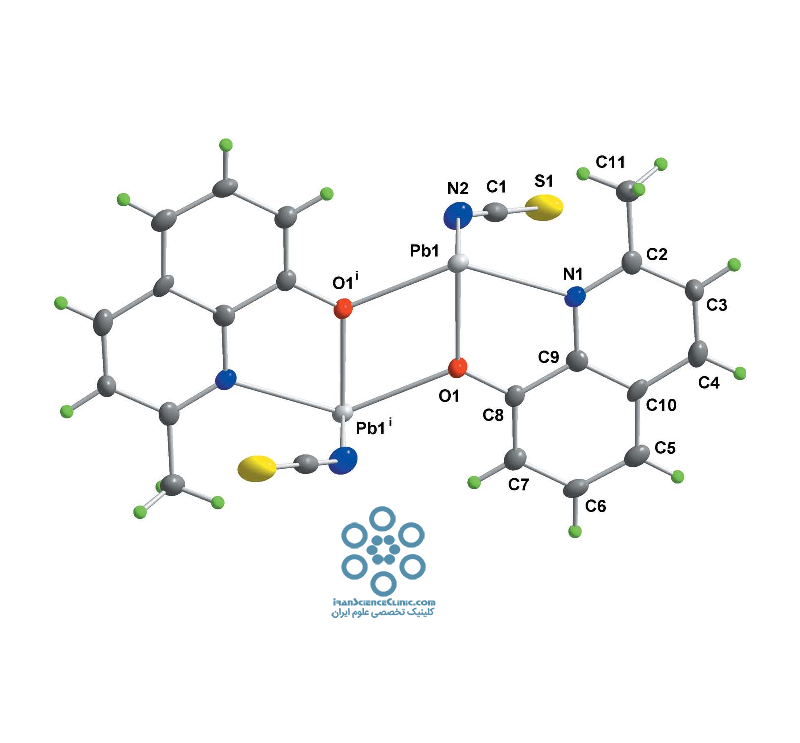
شیمی کوئوردیناسیون سرب (II) بیشتر ترکیبات کوئوردیناسیون سرب به صورت حالت اکسید¬اسیون¬(II) گزارش شده اند و تعداد کمی از ترکیبات شامل سرب(IV) تا کنون تعیین ساختار گردیده اند . سرب(II) یون نسبتاً بزرگی است (شعاع آن Å ۳۳/۱ تا Å ۴۳/۱ است)؛ این ویژگی اجازه می دهد که تنوع وسیعی از اعداد کوئوردیناسیون در کمپلکس های آن وجود داشته باشد. بر این اساس، کمپلکس های سرب(II)، اعداد کوئوردیناسیون از شبه ۱ تا ۱۲ را نشان می دهد و اتم های O، N، S، P، Cl، Br و I اتم های دهنده متداول در قشر کوئوردیناسیونی آن می باشند. از جمله پیچیدگی های موجود در شیمی کوئوردیناسیون سرب، وجود فاصله ی زیاد بین اتم های سرب و اتم های دهنده لیگاندها (Å ۶۵/۲ تا Å ۴۳/۴) در بسیاری از موارد است که تعیین عدد کوئوردیناسیون دقیق فلز را دشوار می کند. هرچند که مجموع شعاع های واندروالسی معیار خوبی برای حد بالای فاصله مربوط به برهمکنش ثانویه فلز-لیگاند است، مقادیر بیشتر شعاع برای سرب(II) را نباید از نظر دور داشت (جدول ۱ )

جدول ۱ : شعاع سرب (II)
استریوشیمی ساختارهای کوئوردیناسیونی حاصل از سرب (II) تحت تأثیرات ساختاری جفت الکترون ۶S۲ شکل می گیرد. جفت الکترون ۶s2 سرب(II) در ساختارهای کوئوردیناسیونی : نقش جفت الکترون تنهای سرب(II) در هندسه کوئوردیناسیون از مطالعات کریستالوگرافی و بهینه سازی های محاسبه های اوربیتال مولکولی بررسی شده است . اثرات ساختاری جفت الکترونهای تنها در فلزات سنگین پسا واسطه مانند، Bi(III)، Tl(I) وPb(II)، موضوعی است که در چند سال گذشته، توجه زیادی به آن شده است. برخی از محققین معاصر، اثر جفت الکترون های تنها را بر روی سرب(II) مطالعه کرده اند و اثرات ساختاری آنها را مورد بررسی قرار داده اند . سرب(II)، با آرایش الکترونیXe۴f۱۴5d۱۰6s۲، یکی از فلزات اصلی است. زوج الکترونی که در اوربیتال۶s وجود دارد زوج بی اثر نامیده می شود. دلیل استفاده از واژه “زوج الکترون بی اثر”، مقاومت زوج الکترون لایه خارجی سرب(II) نسبت به یونش، شرکت در تشکیل پیوند کووالانسی یا پیوند هیدروژنی می باشد. این پدیده را می توان به¬خاطر جاذبه شدید هسته که باعث منقبض شدن اوربیتال ۶s و افزایش انرژی مورد نیاز جهت جدا شدن یا شرکت در تشکیل پیوند می شود توضیح داد. از طرف دیگر، اوربیتالهای d و f به واسطه انبساط شعاعی که حاصل کاهش جاذبه هسته به وسیله الکترونهای s و p است ناپایدار می شوند؛ در نتیجه زوج الکترون لایه والانس پایدار و نسبتاً بی اثر می شود . همچنین بعلت هیبریداسیون اوربیتال ۶s با اوربیتال های ۶p هیبریداسیون sp حاصل می شود، زوج الکترون ۶s از نظر شیمیایی فعال می شود و محلی را در قشر کوئوردیناسیونی اشغال می کند. در واقع نزدیک شدن یک باز لوئیس به یون سرب(II) و تأثیر متقابل آن باعث ایجاد اختلال در اوربیتالهای s، p، d، … شده و این اختلال باعث می شود که اوربیتال s نسبت به اوربیتال p دارای انبساط بیشتری باشند و ناپایدارتر شود. این پدیده باعث کم شدن اختلاف انرژی بین اوربیتالهای p و s شده و هیبریداسیون آن اوربیتالها تسهیل می شود . این پدیده ممکن است شکل مولکول را تحت تأثیر قرار دهد و باعث توزیع غیرکروی بار در اطراف کاتیون +Pb۲ شده و در واقع باعث ایجاد فضای خالی در فضای کره کوئوردیناسیون کاتیون سرب(II) شود. این فضای خالی در فضای کوئوردیناسیون به عنوان شاهدی از یک زوج الکترون فعال از نظر استریوشیمی در نظر گرفته می شود. فضای خالی حاصل از فعالیت زوج الکترون لایه والانس احتمالاً از فضای اشغال شده به وسیله یک پیوند توسط لیگاند بیشتر است. نکته جالب این است که در بعضی از موارد زوج الکترون لایه والانس غیرفعال بوده و پدیده کج شکلی در کره کوئوردیناسیون دیده نمی شود. اگرهیبرید شدن اتفاق نیفتد و جفت الکترون تنها ویژگی s را داشته باشد، این جفت الکترون از لحاظ استریوشیمیایی غیر فعال است و کمپلکس، گپ یا منطقه ی تهی را نشان نمی دهند. آرایش های Holodirected و Hemidirected: مطالعات نشان داده است که دو نوع ساختار از ترکیبات سرب(II) قابل مشاهده است . شکل (۱ ) نمایی شماتیک از ۲ آرایش معمول در ترکیبات کوئوردیناسیونی سرب(II) را به نمایش می گذارد.

شکل۱ : آرایش لیگاندها در کره کوئوردیناسیون سرب(II) الف ـ Holodirected : در آن اتصال اتمهای لیگاند در تمام فضای کوئوردیناسیون سرب(II) پخش شدهاند. ب ـ Hemidirected : در آن اتصال اتمهای لیگاند فقط در یک قسمت از فضای کوئوردیناسیون سرب(II) پخش شده است. در این نوع از ترکیبات یک فضای خالی در توزیع لیگاندهای اطراف کاتیون یافت می شود. شیمونی لیونی و همکارانش توضیح داده اند که تمام ترکیبات سرب(IV) ساختار holodirected را نشان می دهند . وضعیت برای سرب دو ظرفیتی متفاوت است و در سرب(II) علیرغم وجود یک زوج الکترون غیرپیوندی هر دو ساختار هندسی holodirected و hemidirected یافت می شود. همه ترکیبات سرب(II) با اعداد کوئوردیناسیون ۲ تا ۵ ساختار هندسی hemidirected و برای اعداد کوئوردیناسیون ۹ و ۱۰ ساختار هندسی holodirected دارند. برای اعداد کوئوردیناسیون ۶ تا ۸ هر دو ساختار فوق گزارش شده است ولی ساختار هندسی Holodirected برای اعداد کوئوردیناسیون ۶ تا ۸ در حضور لیگاندهای نرم و حجیم مساعدتر است؛ در نتیجه وقتی تعداد لیگاندهای کوئوردینه شونده در اطراف سرب(II) بالا باشد، اثرات فعالیت زوج الکترون لایه ظرفیت کمتر یافت می شود (شکل ۲) .

شکل ۲ مثال هایی از گونه های هندسی اطراف یون سرب در ترکیبات کوئوردیناسیونی سرب . از جمله عواملی که ممکن است در فعالیت یا عدم فعالیت زوج الکترون لایه ظرفیت یون سرب(II) مؤثر باشند عبارتند از : • عدد کوئوردیناسیون • نوع لیگاندها از نظر سخت و نرم بودن • جاذبه یا دافعه بین لیگاندها • بار الکتریکی لیگاندها • اندازه لیگاندها این عوامل توسط قواعد زیر خلاصه می شوند: الف-اعداد کوئوردیناسیون پایین، لیگاندهای سخت (دهنده O یا N) و برهمکنش های جاذبه ای بین لیگاندها یا لیگاندهای چند دندانه ای، همه مناسب ساختار hemidirected می باشند. ب-اعداد کوئوردیناسیون بالا، لیگاندهای نرم (Br-، Cl-، I-) و برهمکنش های دافعه ای بین لیگاندها منجر به ساختار holodirected می شود. با وجود اینکه این قوانین بدون خطا نیستند، می توانند در طراحی کمپلکس های سرب(II)، با ویژگی های ساختاری مشخص مفید واقع شوند. مقدار انرژی لازم برای تبدیل یک ساختار hemidirected به یک ساختار holodirected تحت فشار و در غیاب بر همکنش های قوی بین لیگاندها ، به اندازۀ ۸ – ۱۲ کیلوکالری بر مول محاسبه شده است . طول پیوند Pb–X حضور یک حفره در پراکندگی زاویه ای لیگاندها معمولا بعنوان شاهد برای یک جفت الکترون فعال از لحاظ استرئوشیمی می باشد؛ در صورت وجود شک و تردید، حضور چند نقش مکمل در تعیین کردن حضور جفت الکترون فعال می تواند مفید واقع شود: الف- کوتاه بودن غیر معمول پیوند Pb–X مقابل سایت اشغال شده توسط جفت الکترون. ب- بلند بودن پیوند Pb–X مجاور سایت اشغال شده توسط جفت الکترون. برای ترکیبات سرب(II) hemidirected که در آن جفت الکترون تنها، از لحاظ استرئوشیمی فعال است محیط سه بعدی اطراف جفت الکترون تنها (lp) در ساختار کریستالی بسیار جالب توجه می باشد. تفاوت فواصل Pb–X و Pb–lp–X براساس ساختاری های گزارش شده در CSD از ۳/۰ تا Å ۲/۱ می باشد .کسب دانش عوامل موثر بر هندسۀ کوئوردیناسیون سرب(II)، ممکن است در طراحی عوامل کمپلکس دهنده که می توانند سرب(II) را خارج کنند و آن را از دیگر یون های فلزی بی خطر مانند روی و منگز تمایز دهند، اثر گذار باشد. این امکان با طراحی لیگاندهایی که یک محیط hemidirected از سرب(II) را می سازند، وجود دارد .
Ref :
[۱] Kauffman, G.B. 2005. Coordination Chemistry: History. In: R. Bruce King (ed.). Encyclopedia of Inorganic Chemistry. Second Edition. Wiley., pp. 1030-1032.
[۲] مرسلی، علی. ۱۳۸۹٫ نانوشیمی ابر مولکول ها. چاپ اول. انتشارات دانشگاه تربیت مدرس.
[۳] Bharara, M.S., Atwood, D.A. 2005. Lead: Inorganic Chemistry. In: R. Bruce King (ed.). Encyclopedia of Inorganic Chemistry. Second Edition. Wiley., pp. 2659-2660.
[۴] Sharma, H.K., Pannell, K.H. 2005. Lead: Organometallic Chemistry. In: R. Bruce King (ed.). Encyclopedia of Inorganic Chemistry. Second Edition. Wiley., pp. 2671-2678.
[۵] Casas, J.S., Sordo, J. Vidarte, M.J. 2006. Lead(II) coordination chemistry in the solid state. In: J., Casas, S., J. Sordo (ed.). LEAD Chemistry, Analytical Aspects, Environmental Impact and Health Effects. Elsevier., pp. 41-99.
[۶] Batsanov, S.S. 1999. Calculation of van der Waals radii of atoms from bond distances. J. Mol. Struct., 468: 151-159.
[۷] Shimoni-Livny, L., Glusker, J.P., and Bock,C.W. 1998. Lone Pair Functionality in Divalent Lead Compounds, Inorg. Chem., 37: 1853-1867.
[۸] Hancock, R.D., Reibenspies, H.J., and Maumela, H. 2004. Structural Effects of the Lone Pair on Lead(II), and Parallels with the Coordination Geometry of Mercury(II). Does the Lone Pair on Lead(II) Form H-Bonds? Structures of the Lead(II) and Mercury(II) Complexes of the Pendant-Donor Macrocycle DOTAM (1,4,7,10-Tetrakis(carbamoylmethyl)-1,4,7,10-tetraazacyclododecane). Inorg.Chem., 43: 2981-2987.
[۹] Hancock, R.D., Shaikjee, M.S., Dobson, S.M., and Boeyens, J.C.A. 1988. The Stereochemical activity or non-activity of the ‘Inert’ pair of electrons on lead(II) in relation to its complex stability and structural properties. Some considerations in ligand design. Inorg. Chim. Acta, 154: 229-238.
[۱۰] Luckay, R., Reibenspies, J.H., and Hancock, R. D. 1995. Synthesis and structure of a complex of bismuth(III) with a nitrogen donor macrocycle, J. Chem. Soc., Chem. Commun., 2365-2366.
[۱۱] Luckay, R., Cukrowski, L., Mashishi, .J., Donrl, A.U., Rogers, R.D., and Hancock, R.D. 1997. Synthesis, stability and structure of the complex of bismuth(III) with the nitrogen-donor macrocycle 1,4,7,10-tetraazacyclododecane. The role of the lone pair on bismuth(III) and lead(II) in determining co-ordination geometry. J. Chem. Soc., Dolton Trans., 901-908.
[۱۲] McKeney, D. R. 1983. Relativistic effects on chemical properties. J. Chem. Educ., 60:112-116.
[۱۳] Pykkö, P. 1988. Relativistic effects in structural chemistry. Chem. Rev., 88: 563-594.
[۱۴] Hanna, M. S. 1985. Relativistic effects at the freshman level. J. Chem, Educ., 62: 197.
[۱۵] Pitzer, K.S. 1979. Relativistic effects on chemical properties. Acc. Chem. Res., 12, 271-276.
[۱۶] Pykkö, P. 1988. Relativistic effects in structural chemistry. Chem. Rev., 88: 563-594.
[۱۷] Shimoni- Livny, L., Glusker, J. P., Bock, C.W. 1998. Lone Pair Functionality in Divalent Lead Compounds. Inorg. Chem., 37: 1853-1867.