کاربرد زئولیت ها
عنوان مقاله : کاربرد زئولیت ها[۱]
چکیده
زئولیت ها، آلومینوسیلیکاتهای بلورین هستند که ساختارهای ویژه و حفره دار دارند. زئولیت ها ویژگی های خاصی مانند توانایی تبادل یونی[۲]، جداسازی مولکولها بر اساس شکل و اندازه، خاصیت کاتالیزوری دارند که باعث شده در صنایع کاربرد زیادی داشته باشند. که این کاربرد ها عبارتند از: تبادلگر یونی، جاذب رطوبت، نرم کننده آب، کراکینگ کاتالیزوری نفت و همچنین نقش کاتالیزوری زئولیت ها در سنتز ترکیبات آلی چشمگیر است که موجب می شود فرآورده هایی با درصد خلوص و گزینش پذیری بالا بدست آید.
مقدمه
زئولیت ها، آلومینو سیلیکاتهای بلورین با فرمول عمومی [(AlO۲)x(SiO۲)y]x-.zH۲O هستند که M می تواند کاتیون فلزی یا یون H+ باشد. نسبت در زئولیت ها در گستره زیادی تغییر می کند. اسکلت اصلی هر زئولیت از واحدهای چهاروجهی TO۴، ساخته شده است که T می تواند اتم سلیسیم یا آلومینیوم باشد.
اولین زئولیت سنتزی به نام آنالیست در سال ۱۹۳۰ سنتز گردید و در سالهای بعد، روش سنتز و خصوصیات زئولیت ها شامل ظرفیت تبادل یونی، پایداری و توانایی جذب برای مطالعه مورد توجه قرار گرفت، خاصیت تبادل یونی ناشی از ساختار ویژه آنها است. تبادل یونی در زئولیت ها به عواملی چون ماهیت زئولیت، اندازه بار، میزان هیدراتاسیون
تغییر داد. همچنین زئولیت ها یک ساختمان حفره دار دارند که فقط مولکولهایی می توانند از منافذ
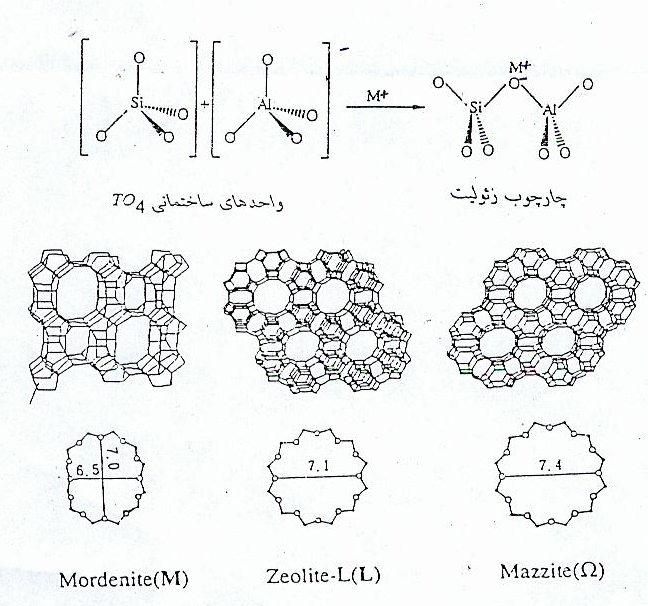
شکل ۱- چهارچوب زئولیت و ساختار چند نمونه از زئولیت ها
عبور کنند که قطر آنها کوچکتر از قطر مؤثر مدخلها است و به این ترتیب مولکولهایی با اندازه متفاوت را می توان از هم جدا کرد که به همین دلیل به زئولیت ها اصطلاحاً الک های مولکولی[۳] نیز می گویند. لازم به ذکر است حدود کاربرد زئولیت ها در صنعت بعنوان کاتالیزگر بکار می رود که نقش مهمی را در صنعت بعهده دارد.
واژگان : زئولیت ، الک مولکولی ، گزینش پذیری
چند نمونه از کاربرد زئولیت ها:
۱- زئولیت ها بعنوان جاذب رطوبت
الف- شیشه های چند جداره:
بین دو جدار شیشه هوا یا یک گاز وجود دارد. برای اینکه سطح داخلی شیشه ها عرق نکند گاز مربوطه بوسیله دانه های زئولیت خشک نگهداشته می شود. خواص جذب دانه های زئولیت آنقدر خوب است که سطح داخلی شیشه ها حتی در دماهای خیلی پائین( تا ۷۰- درجه سانتی گراد) عرق نمی کند. علاوه بر آن در اثر تابش شدید خورشید هم واجذب مشاهده نمی شود. که اگر این چنین نبود در اثر حرارت، بخار آب منبسط شده و ایجاد فشار می نمود که موجب خطر می شود.
ب- خنک کننده ها( یخچالها):
در سیکل خنک کننده یخچالها، فریزرها و غیره، غالباً هیدورکربن های فلوئوره شده مصرف می شود( بعنوان خنک کننده). برای جلوگیری از زنگ زندگی و همچنین خشک نمودن مواد خنک کننده در مسیر عبور گازهای خنک کننده، دانه های زئولیتی قرار می دهند که مواد خنک کننده از دانه های زئولیتی عبور کرده و بدین ترتیب خشک باقی می ماند.
۲- زئولیت ها بعنوان نرم کننده آب سخت
شوینده های سنتزی:
شوینده ها در مصارف خانگی موجب افزایش po۴۳- در فاضلاب ها و نهایتاً در پسابها می شوند که این مسئله بویژه در پسابهای راکد، موجب متعفن شدن می شود و همچنین موجب رشد سریع جلبک ها شده و جلبک ها اکسیژن آب را مصرف می کنند که باعث از بین رفتن آبزیان می شود. بنابر این در صنعت همیشه سعی می کردنند ومی کنند که موادی جایگزین برای فسفاتهای مورد استفاده در شوینده ها پیدا کنند.
در حال حاضر مهمترین ماده مورد استفاده در شوینده ها، زئولیت A است این زئولیت بعلت گزینش پذیری بالایی که نسبت به مبادله یون Ca۲+ دارد، یون Ca۲+ و مقدار جزئی هم یون Mg۲+ را از آب و چرک خارج می سازد و موجب افزایش پاک کنندگی می شود. چون زئولیت A قابلیت حل کردن چرک را ندارد. به همین دلیل استفاده کم از فسفات ها در شوینده ها هم ضروری است که چرک را از لباس جدا کند و موجب پاک شدن لباس شود.
۳- زئولیت ها بعنوان کاتالیزورهای شکل گزین
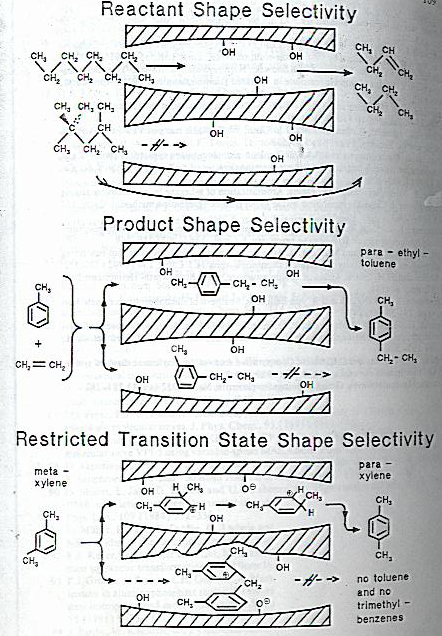
چون زئولیت ها ساختار حفره ای دارند، تنها مولکولهایی که کوچک تر از اندازه حفره باشند می توانند از منافذ زئولیت ها عبور کننده و آنهایی که بزرگتر باشند عبور نکرده و باقی می مانند به همین دلیل به زئولیت ها الک های[۴] مولکولی یا غربالهای مولکولی می گویند. همین امر موجب شده که زئولیت ها در واکنش های شیمیایی بعنوان کاتالیزگر ها ی شکل گزین عمل کنند. کاتالیزرهای شکل گزین به سه دسته تقسیم شده اند:
الف. شکل گزینی بر اساس شکل واکنشگر[۵]
شکل ۲آ رقابت میان n- اکتان و ۲و ۲و ۴ تری میتیل پنتان را برای کراکینگ نشان می دهد. مولکولهای ۲و۲و۴- تری متیل پنتان در موقع وارد شدن واکنشگر ها به حفره های زئولیتی بعلت حجیم بودن از مخلوط واکنشگر خارج می شود. بنابراین از رسیدن به مقرهای کاتالیزوری داخل حفره ها باز می ماند و آنها فقط در مقرهای کاتالیزری که در سطح خارجی کریستالهای زئولیت قرار دارد می توانند تبدیل شوند که بعلت کم بودن تعداد مقرهای فعال خارجی، مقدار خیل کمی از آن تبدیل شده و بقیه بدون تبدیل رآکتور را ترک می کنند. ولی مولکولهای n- اکتان بعلت اینکه براحتی وارد حفره های داخلی می شوند در نتیجه اکثراً به محصول تبدیل می شوند.
ب- شکل گزینی بر اساس شکل محصول[۶]
شکل۲آ مثالی از کاتالیزورهای اسیدی برای اتیل اسیون تولوئن را نشان می دهد.
واکنشگرها به اندازه کافی کوچک هستند و به راحتی وارد حفره های زئولیت می شوند. اما محصولاتی می توانند حفره ها را ترک کنند که به اندازه کافی کوچک باشند( یعنی از ایزومرهای ارتو، متا و پارا، فقط پارا به راحتی از حفره ها خارج می شود.) محصول با مولکولهای حجیم تر(m,o) فقط ممکن است در حفره های نسبتا بزرگ (محل تقاطع کانالها) تشکیل شوند ولی نمی توانند از حفره ها خارج شوند. سرانجام این مولکولها تغییر شکل می دهندو به ایزومر پارا تبدیل می شوند تا کوچکتر شده وبتوانند از حفره ها خارج شوند.
پ-. شکل گزینی بر اساس شکل حلت گذار[۷]
شکل۲آ- رقابت میان ایزومریزاسیون و الکالیزاسیون متاگزیلن را نشان می دهد.
تحت تأثیر یک مقر اسیدی متاگزیلن می تواند متحمل ایزومریزاسیون شده و به پاراگزیلن تبدیل شود. در شرایطی که
آ ب
شکل۲- مثالی از سه نوع شکل گزینی
اگر از زئولیت استفاده نشود، همراه واکنش ایزومریزاسیون، واکنش الکالیزاسیون هم صورت می گیرد که منجر به تولید تولوئن و تری متیل بنزن می شود.واکنش ایزومریزاسیون از حالت گذاری که حدواسط یک مولکولی دارد می گذرد ولی آلکالیزاسیون از حالت گذاری که حدواسط دو مولکولی دارد می گذرد. اما در یک زئولیت با عرض حفره های مناسب، اتافک هایی به اندازه کافی مناسب و راحت برای حالت گذار با حدواسط یک مولکولی وجود دارد ولی اتافک های مناسب برای تشکیل حدواسط های حجیم دو مولکولی را ندارد. در نتیجه زئولیت مانع از واکنش الکالیزاسیون می شود و واکنش فقط از طریق ایزومریزاسیون پیش می رود.
۴- زئولیت ها کاتالیزورهای ناهمگن با خصوصیات ویژه
در دنیای صنعتی امروزه کاتالیزورها نقش مهمی را در فرآیندهای صنعتی ایفاء می کنند، برای شیمیدانان امروزی کاتالیزور اکسیری است که توسط آن مواد اولیه و ارزان قیمت به فرآورده های با ارزشی چون سوخت، پلاستیک، دارو، … تبدیل می شود.
در این میان زئولیت ها با توجه به خواص ارزنده خود به عنوان کاتالیزورهای ناهمگن نقش برجسته ای دارند ویژگی های خاص زئولیت ها نظیر بر جذب و خواص تعویض یونی از مدتها پیش شناخته شده اند ولی آنچه امروزه استفاده از زئولیت ها را در صنایع رونق بخشیده است، خواص کاتالیزوری آنها است، استفاده از کاتالیزور زئولیتی موجب تحول عظیمی در کراکینگ کاتالیزوری شده. بر اساس گزارش سال ۱۹۹۲ مجمع تحقیقات ملی در ایالات متحده استفاده از زئولیت ها که از سال ۱۹۶۲ آغاز گردیده موجب افزایش فوق العاده ای در میزان تبدیل نفت خام به بنزین شده است. این مسئله موجب کاهش مصرف چهارصد میلیون بشکه نفت در سال گردیده که معادل هشت میلیارد دلار صرفه جوئی در سال شد.
۵- کاربرد زئولیت ها برای سنتز ترکیبات آلی
 الف- سنتز پیرولیدین از THF
الف- سنتز پیرولیدین از THF
Conv% Sel% زئولیت
۵۳ ۹۱ HL
۶۱ ۸۲ HY
 ب- سنتز پیرول و تیوفن از فوران
ب- سنتز پیرول و تیوفن از فوران
Sel: 100%
Conv: 14%
 پ- سنتز گاما- بوتیرولاکتون از ۱و۴- بوتان دی ال
پ- سنتز گاما- بوتیرولاکتون از ۱و۴- بوتان دی ال
Sel:91.5%
Conv:99.4%
ت- اکسیداسیون شیمیایی با استفاده از زئولیت TS-1
۶- کاربردهای دیگر از زئولیت ها
۱- حذف مواد آلوده کننده ای نظیر NO۲ , NO, SO۲ , CO از گازهای خروجی اگزوز اتومبیل ها .
۲- فرایند جداسازی از قبیل جداسازی هیدورکربن های مختلف – جداسازی مخلوط گلوکز و فروکتوز- جداسازی آنتی بیوتیک ها.
۳- در ساختن بعضی از معرف های ضدباکتری و میکروب، که به این منظور از فرم تعویض شده یون نقره بجای یون سدیم زئولیت های Xو Y استفاده می شود.
۴- بعنوان اطفاء حریق که این کار از طریق آزادسازی گازهای برجذب شده ای مثل بخارآب و دی اکسید کربن، آزاد کردن بازدارنده های شعله مثل هالیدهای آلی.
۵- حذف کاتیونهای فلزهای سنگین سرب، روی، کلسیم، کادمیم و نیکل از پساب های صنعتی.
۶- با توجه به اینکه تاکنون امکان ساخت منبع ذخیره هیدروژن به شکل ایمن و کارا وجود نداشته که بتوان از آن بعنوان سوخت در خودرو استفاده کرد ولی می توان گاز هیدروژن را در حفره زئولیت ها ذخیره کرده و در مواقع لازم آنرا آزاد کرده و استفاده نمود.
نتیجه گیری
با توجه به اینکه زئولیت ها ساختار حفره دار دارند و همچنین می توانند یونهایی را مبادله کنند و بعلت اینکه می توانیم انواع فلزها را در چارچوب آنها قرار دهید. به همین دلیل کاربرد کاتالیزوری زیادی در صنایع پیدا کرده و لذا با توجه به اینکه در واکنش های آلی می تواند با استفاده از زئولیت ها محصولی با درصد تبدیل وگزینش پذیری بالا بدست آورد. پس لازم است که در کشور ما تحقیقات زیادی روی زئولیت ها انجام شود.
منابع
-
J.Weitkamp,S.Ernst. / Catalysis Today 19(1994)107-150
-
C.B.Dartt, M.E.Davis/ Catalysis Today 19(1994)151-186
-
Y.Sugi,M, Toba/ Catayisis Today 19(19994)187-212
-
علی اکبر هاشمی پژند، پایان نامه کارشناسی ارشد، ۱۳۷۶، دانشگاه گیلان
-
جزوه درسی شیمی آلی- فلزی پیشرفته، دکتر یزدان بخش، دانشگاه گیلان
-
حسین قاسمی مبتکر، حسین کاظمیان ( از سازمان انرژی اتمی ایران )، نشریه شیمی و مهندسی شیمی ایران، مجله دوره ۲۴ شماره ۲ سال ۱۳۸۴،
-
مریم اعظم، پایان نامه کارشناسی ارشد، دانشگاه اصفهان ۱۳۸۲
-
سایت www.irannano.org

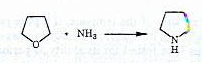 الف- سنتز پیرولیدین از THF
الف- سنتز پیرولیدین از THF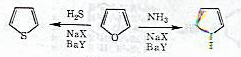 ب- سنتز پیرول و تیوفن از فوران
ب- سنتز پیرول و تیوفن از فوران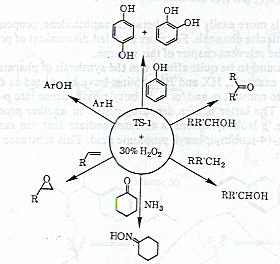
۱ دیدگاه دربارهٔ «کاربرد زئولیت ها»
عالی